KIÉ A KORONA?
Hatóanyagok agyba juttatása a nazális útvonalon keresztül
Article in Gyógyszerészet · January 2009
Horvát Sándor, Kis Loránd, Szabóné Révész Piroska, Erős István, Deli Mária
1. Bevezetés
1.1. A vér-agy gát és gyógyszerek bejuttatása a központi idegrendszerbe
A vér-agy gát az agyi mikroerek falát alkotó endotélsejtek szoros zárókapcsolatai és specifikus transzportrendszerei révén kialakult határfelület, amely precízen szabályozza a véráramban keringő anyagok agyszövetbe kerülését. A vér-agy gát elsődleges feladata az agyi homeosztázis, vagyis az állandó belső környezet fenntartása a megfelelő idegi működés biztosításához. Ehhez elengedhetetlen, hogy ne egy áthatolhatatlan falként működjön, hanem egy pontosan szabályozott rendszerként, amely a megfelelő idegi működéshez és a kognitív funkciók ellátásához szükséges tápanyagokkal látja el agyunkat. Egészségesen működő vér-agy gát esetén csupán a lipofil és viszonylag kis molekulatömegű anyagok képesek szabadon, passzív transzporttal az agyszövetbe jutni [1]. Ilyenek például az emberiség által régóta ismert és előszeretettel alkalmazott tudatmódosító és serkentőszerek (alkohol, kokain, nikotin). Hidrofil és nagy molekulatömegű anyagok (Mw>400-500 Da) azonban csak speciális transzportrendszerek segítségével juthatnak a vérkeringésből a központi idegrendszerbe. Sajnos az idegrendszeri betegségek kezelésére kifejlesztett potenciális farmakonok mintegy 98%-a nem kis molekulatömegű, lipofil hatóanyag, ezért képtelen átjutni a vér-agy gáton. Ez jelentős akadályt gördít a neurodegeneratív és egyéb neurológiai betegségek kezelése elé. Természetesen léteznek különböző stratégiák e probléma leküzdésére [2]. Módosítható a vér-agy gát működése az erek permeabilitásának növelésével, az efflux, vagyis az agyból kifelé irányuló transzportpumpák gátlásával, vagy a szoros kapcsolatok modulációjával [3]. A hatóanyagok módosítása is járható út. Növelhető például a molekula lipoid-oldékonysága, vagy pozitív elektromos töltéssel látható el a molekula. Mindkét módszer fokozza az átjutást a vér-agy gáton. Fontos azonban figyelembe venni, hogy a farmakon kémiai módosítása a hatás megváltozásához vezethet. Egy harmadik módszer a vér-agy gát megkerülése alternatív beviteli kapuk kihasználásával; ilyen alternatív útvonal az általunk tárgyalt nazális út.
Agyunkat a keringéstől elválasztó vér-agy gát egy dinamikus, több sejt kölcsönhatásával szabályozott határfelület, amely a legtöbb lehetséges farmakon agyba kerülését megakadályozza. A hatóanyagok agyszövetbe juttatásához elengedhetetlen a vér-agy gáton keresztüli transzport megvalósítása, vagy alternatív utak – mint például a nazális útvonal – kiaknázása. Ez a közvetlen út hatékonyan hasznosítható a szaglóhám különleges anatómiai és élettani sajátosságainak köszönhetően. Állatkísérletes adatok és humán vizsgálatok is igazolták, hogy a nazális úton a zsíroldékony, kis molekulák mellett peptidek és fehérjék is bevihetők az idegrendszerbe. Mindemellett a gyógyszerhordozók megfelelő formulálása is rendkívül fontos. Kísérleteinkben mukoadhezív és abszorpciót fokozó vivőanyagok együttes alkalmazásával növelni tudtuk a tesztvegyület dextrán és a bioaktív béta-amiloid peptid bejutását az orrüregből különböző agyterületekre. A nazális út ígéretes lehet idegrendszeri támadáspontú, a vér-agy gáton át nem jutó molekulák terápiás alkalmazására.
1.2. Alternatív útvonalak az agyba: a nazális út
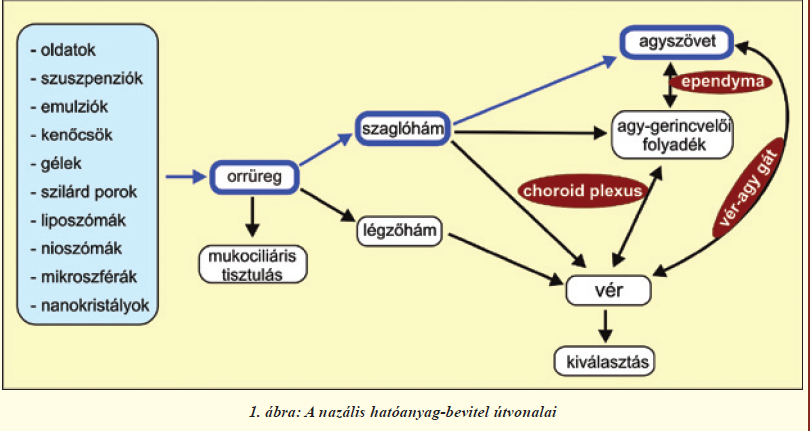
A klinikumban idegrendszeri fertőzések, agyi daganatok kezelésére a hatóanyagokat a vér-agy gát megkerülésével, közvetlenül is bejuttathatjuk az idegrendszerbe. Így katéteren keresztül a gyógyszereket az agy-gerincvelői folyadékba, vagy közvetlenül az agyszövetbe, illetve a tumorszövetbe injektálhatják. A tumorok kezelésénél használatosak még gyógyszeres szivacsok, minipumpához csatlakoztatott beültetett kanülök. Azonban ezek invazív módszerek, fájdalommal és szövődményekkel járhatnak. Az intranazális agyba juttatásnak számos előnye van a fenti alternatív útvonalakkal szemben. Számunkra legfontosabb, hogy kihasználásával a hatóanyagok az orrüregből közvetlenül az agyszövetbe jutnak (1. ábra). Akár az idegrendszerbe, akár a szisztémás keringésbe juttatunk be anyagokat a nazális úton [4], alkalmazása nem invazív, egyszerű, fájdalommentes, kiküszöböli a máj és a vese first pass eliminációs mechanizmusát. A nazális út régóta ismert és használt gyógyszerbeviteli útvonal. A legismertebb nazális készítmények a nátha, illetve allergiás tünetek kezelésére szánt lokális hatású orrspray-k, orrcseppek. Továbbá az orrnyálkahártya szerkezeti felépítésének köszönhetően nazális vakcinálás is kivitelezhető, amelyben a szisztémás mellett lokálisan az orrnyálkahártyán is kialakul az immunválasz, ily módon sokkal nagyobb mértékű védettség érhető el. A szisztémás alkalmazás kevésbé ismert, de a gyógyászatban már megtalálhatóak, illetve jelenleg kutatási fázisban is vannak ilyen készítmények [4]. Olyan esetekben érdemes ezeket a gyógyszereket felhasználni, amelyekben azonnali gyors hatásra van szükség, mint például sürgősségi fájdalomcsillapításra migrén esetén, vagy amikor hosszú távú gyógyszeres terápia szükséges, mint például diabetes mellitus kezelésére, ahol így nincs szükség állandó, fájdalmas injekciókra és a gasztrointesztinális rendszer is kikerülhető [4]. Az intranazális útvonal egy további kihasználási módja a központi idegrendszerbe történő hatóanyag-bevitel. Ezzel a módszerrel különböző vegyületek az orrüregből közvetlenül az agyszövetbe juttathatók, megkerülve a vér-agy gátat és a vér-cerebrospinális folyadék gátat (1. ábra). Számos tanulmány igazolta az útvonal működését mind állatkísérletekben, mind önkénteseken végzett humán vizsgálatokban (I. és II. táblázat). Ezek részletezésével közleményünk 2. fejezete foglalkozik. Az útvonal működésének megértéséhez mindenekelőtt tekintsük át az orrüreg szaglóhámjának anatómiai és élettani jellemzőit.
1.3. A szaglóhám felépítése és élettani jellemzői
A szaglóhám egy módosult légzőhám, amely speciális szerkezetének köszönhetően szagok detektálására alkalmas; az orrüreg hátsó, felső részén található [4, 5]. Amíg kifinomultabb szaglással rendelkező emlősöknél, például kutyáknál, a felülete elérheti a 170 cm2-t, addig az emberi szagló régió 10 cm2-es felülete meglehetősen kicsiny az orrüreg 150 cm2-es teljes kiterjedéséhez képest, jelentősége mégis nagy. A szaglás fontos elsődleges információforrás a külvilágról és befolyásolja az ízlelést és a magatartást is. Mivel a szaglóhám a nyugalmi légáramlás fölött helyezkedik el, az illatanyagok diffúzióval jutnak az epitélsejteket borító nyálkarétegre. Ez a diffúzió fokozható erőteljesebb légáramlás gerjesztésével, szimatolással. (Így vagyunk képesek egy virág kellemes, vagy a vasárnapi ebéd ínycsiklandó illatait érezni.)
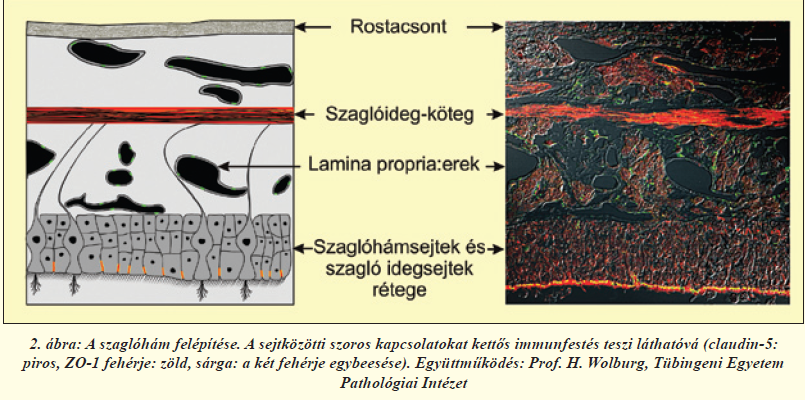
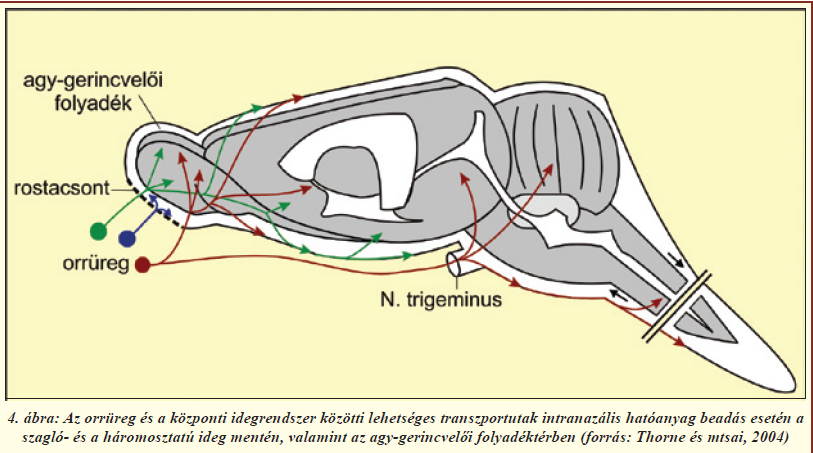
A szaglóhámban található receptorok bipoláris idegsejtek, sejttesteik a laphámsejtek rétegében helyezkednek el, dendritjeik közvetlen kapcsolatban állnak a külvilággal, axonjaik pedig átkapcsolódás nélkül, a szitaszerű szerkezetű rostacsonton áthatolva a szaglógumóba futnak (2. és 4. ábra). Az ilyen primer érzékhám egyedülálló az emberi szervezetben. A szagló és légzőhám legfontosabb eleme a nyákkal fedett, többrétegű, csillós laphám (2. ábra). A laphámsejteket (más néven epitélsejteket) szoros kapcsolatok kötik össze. A kapcsolatokat alkotó fehérjék közül többet már azonosítottak; ilyen sejtmembránban ülő molekula a claudin-5, illetve a kapcsolatok területén a sejthártya belső oldalán elhelyezkedő ZO-1 fehérje. A Tübingeni Egyetemmel folyó együttműködésünkben megvizsgáltuk a patkány szaglórendszerében a sejtek közötti kapcsolatokat alkotó fehérjéket (2. ábra). Immunfestéssel igazoltuk, hogy ezek a fehérjék a laphámsejtek közötti kapcsolatokban, a szaglórostokat burkoló sejtekben és az erek belhámsejtjeiben (endotélsejtek) megtalálhatóak más kapcsolati fehérjékkel együtt, és felelősek a felszívódási jellemzőkért [6]. Ugyanakkor, ahogy azt jelzőfestékek intravénás bejuttatásával állatkísérletünkben megerősítettük, mind a légző-, mind a szaglóhám nagyságrendekkel nagyobb áteresztőképességgel rendelkezik az agyi hajszálerekhez képest (3. ábra), így gyógyszerek szisztémás keringésbe való bevitelére [4], vagy központi idegrendszerbe való bejuttatására [5, 7] ígéretesnek mutatkozik.
2. Kísérletes adatok a nazális gyógyszerbevitel területén
2.1. Állatkísérletek
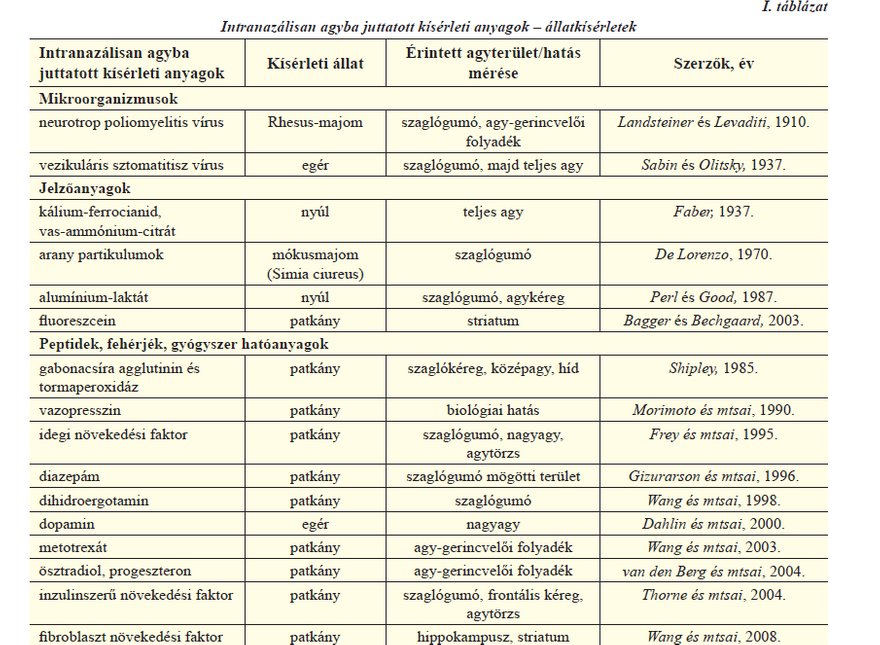
A huszadik század eleje óta ismert, hogy az agyat megfertőző vírusok számára az orrüreg szaglórégiója fontos támadási pont. Az ezzel kapcsolatos kutatásokat az I. táblázat foglalja össze [5]. Az első ilyen irányú dokumentált vizsgálat során Landsteiner és Levaditi 1910-ben poliomyelitis vírussal intranazálisan megfertőzött Rhesus majmok agyának szaglógumójában és agy-gerincvelői folyadékában kimutatták a kórokozót. Később egérkísérletekben megfigyelték, hogy a vezikuláris stomatitis vírus a szaglórégióra juttatva néhány perc, ill. öt óra eltelével nem mutatható ki az agyban, viszont két nap múlva megfertőzte a legtöbb állat szaglógumóját. Fiatal egyedeknél öt nap után a vírus elárasztotta az egész agyat és az egerek encephalitis következtében elpusztultak. Tehát kijelenthető, hogy egyes vírusok a szaglóidegek mentén elérhetik az agyat, azonban ez egy viszonylag lassú, több napot igénylő folyamat. Különböző jelzőanyagokkal is számos kísérletet végeztek, és végeznek ma is (I. táblázat). William M. Faber 1937-es közleményében arról számol be, hogy nyulaknak nazálisan beadott kálium-ferrocianid, ill. vas-ammónium-citrát bejutott az agyba, viszont a
transzportmechanizmust akkor még nem tisztázta. Erre a múlt század második felében került sor, amikor 198Au izotóppal jelzett arany partikulumokat juttattak mókusmajmok orrüregébe és a partikulumok útját elektronmikroszkópiával követték. A beadás után 15 perccel az arany partikulumok a szaglóreceptorok csúcsán helyezkedtek el, 30-60 perc múlva pedig elérték a szaglógumót. Ezen adatok alapján kiszámolták, hogy a szaglóneuronban a transzportsebesség 2,5 mm óránként. Perl és Good 17 évvel később alumínium-laktát oldattal nazálisan kezelt nyulakat vizsgált, és kimutatta az anyag jelenlétét a szaglógumóban, valamint az agykéreg makrofágjaiban és limfocitáiban. A kísérletek alapján egy lehetséges összefüggést feltételeztek az Alzheimer-kór és a levegőben előforduló ammónium-szilikát között. Bagger és Bechgaard 2003-ban egy jól ismert hidrofil modellanyag, a fluoreszcein intranazális bevitelével végzett kísérleteket. Patkányok jobb orrüregébe juttatták a modellanyagot, majd mikrodialízis vizsgálattal detektálták a megjelenését a vérben és az agy striatum régiójában. Nagyobb koncentrációt mértek a beadással azonos oldali striatumban, mint az ellenkező oldalon és a vérben. Újabban peptideket, fehérjéket és gyógyszerhatóanyagokat is megkísérelnek az intranazális út kihasználásával a központi idegrendszerbe juttatni (I. táblázat). Shipley 1985-ben kimutatta, hogy a gabonacsíra agglutinin és tormaperoxidáz konjugátum patkányok orrüregéből az agy számos területére eljutott, amit fénymikrószkópiával követni is tudott. Morimoto és munkatársai 1990-es cikkükben arról számolnak be, hogy a jól ismert bioadhezív karakterű hialuronsav hordozóban vazopresszin és egy analógjának biológiai hatását vizsgálták intranazális beadást követően a patkányok vizeletének mennyisége alapján. Azt tapasztalták, hogy a hatóanyagok antidiuretikus hatása magasabb volt a hialuronsavat tartalmazó hordozó esetében, mint fiziológiás sóoldathoz adva, ami arra utalt, hogy a mukoadhezív hialuronsav növelhette a hatóanyag agyba jutását, de ezt ők közvetlenül nem mérték. Frey és munkatársai egy 1995-ben megjelent közleményben leírták, hogy radioaktív izotóppal jelölt idegi növekedési faktor nazális beadás esetén eléggé gyorsan, kevesebb, mint 20 perc alatt elérte a szaglógumót. A szerzők feltételezték, hogy a transzport nem axonálisan történik, mivel az sokkal lassabb folyamat, és ezt a későbbiekben igazolták is. Egy évvel később Gizuarson munkatársaival megállapította, hogy a diazepám gyógyszer 10 perccel a beadást követően a szaglógumón áthaladva, a távolabbi agyterületeken detektálható. Wang és munkatársai 1998-ban migrén kezelésére használt dihidroergotaminnal végzett kísérleteiből kiderült, hogy a hatóanyag eléri a szaglógumót, viszont a vérplazmában jóval kevesebb mutatható ki, ami az orrüregből a nazális útvonalon át közvetlenül az idegrendszerbe való gyógyszerbejutást igazolja. Az utóbbi néhány évben egyre több kutatócsoport tett kísérletet többek között gyógyszerhatóanyagok, neurotranszmitterek, illetve különféle növekedési faktorok intranazális agyba juttatására főleg állatmodellek esetében, de a humán vizsgálatok úgyszintén egyre inkább előtérbe kerülnek.
2.2. Humán vonatkozások
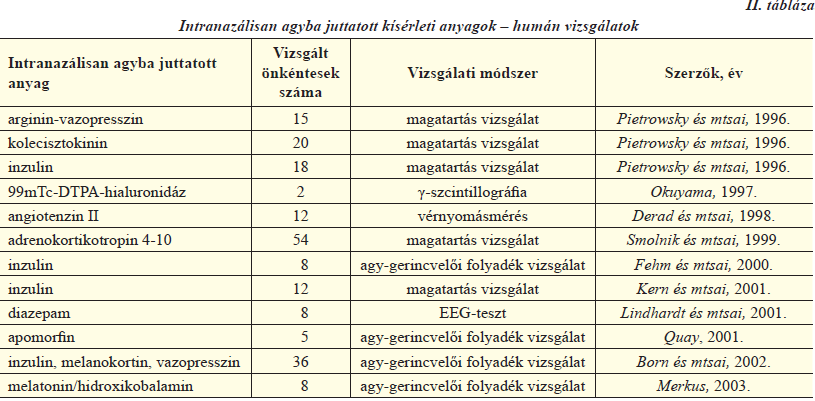
A nazális útvonallal kapcsolatos vizsgálati adatok emberen az 1990-es évek közepe óta állnak rendelkezésre. Nyilvánvaló, hogy a legtöbb kísérletben nem lehetséges a hatóanyag agyba jutásának direkt mérése, viszont mérhető a farmakológiai hatás különböző élettani folyamatokban történő változás, vagy magatartásvizsgálatok által. Az ilyen irányú tanulmányok összegzését a II. táblázatban láthatjuk [5, 7]. Egyik legismertebb nem terápiás humán alkalmazása a nazális úton történő agyi bejuttatásnak a kokain használata. Ezt a dél-amerikai kokacserje leveléből kivont alkaloid kábítószert tudatmódosító hatása miatt használják. Legjellemzőbb beviteli módja a por formájú vegyület orrüregbe történő felszippantása. Idegrendszeri hatását meglehetősen gyorsan, általában tizenöt percen belül kifejti, ami körülbelül egy órán át tart. Tiltott és veszélyes szer a káros mellékhatásai és a dependencia kialakulása miatt. Pietrowsky és munkatársai 1996-ban 15 önkéntes vizsgálata során bizonyították, hogy arginin-vazopresszin intranazális beadására az agy elektrofiziológiai válaszreakciója megnövekedett egy külső stimulus hatására a placebo formuláláshoz és a peptid intravénás beadáshoz képest, vagyis az önkéntesek jobb teljesítményt nyújtottak egy hallásfigyelem teszt során, ha nazálisan kapták a peptidet. Ugyanez a kutatócsoport hasonló eredményeket ért el kolecisztokinin és inzulin alkalmazásával is. Derad és munkatársai 1998-as vizsgálata szerint angiotenzin II intranazális és intravénás beadás esetén is hasonlóképpen megemeli a vérplazma angiotenzin II szintjét és a vérnyomást. Azonban a későbbi vérnyomás-profilok eltérőek voltak a beadás módjától függően. A nazálisan beadott angiotenzin II ellensúlyozta az intravénás beadásnál megfigyelhető noradrenalinszint csökkenést, valamint növelte a vazopresszin plazmaszintjét. Az eltérő hatások az orrtól az agyba történő közvetlen transzportot támasztják alá. Smolnik és munkacsoportja 1999-ben egy nagyobb szabású, 54 egészséges önkéntes bevonásával végzett klinikai tanulmányt folytatott. A korábbiakban leírt magatartásvizsgálattal tanulmányozták az adrenokortikotropin 4-10 hormon hatását akut, illetve krónikus nazális adagolás esetén. Akut kezelést követően a figyelem fókuszálásának csökkenését észlelték, míg szubkrónikus kezelésnek (1 mg/nap 6 héten keresztül) nem volt hatása.
A fent vázolt kísérletek a nazális transzportmechanizmus létét indirekt módon bizonyították, azonban rendelkezésre állnak közvetlen bizonyítékok is a beviteli út igazolására. Okuyama kísérelte meg elsőként 1997-ben a nazális transzportút létét direkt módon is alátámasztani. Radioaktív izotóppal jelölt dietiléntriamin-pentaecetsavat hialuronidázzal keverve spray formában juttatott mélyen az orrüregbe. Egy egészséges 60 éves férfi és egy szagláshiányos 67 éves nő volt a tesztalany. Öt perccel a beadás után γ-szcintillográfiával szignifikánsan magasabb radioaktivitás volt detekIItálható a női páciens agyában. Ez valószínűleg a szaglóérzék hiánya miatt a szaglóhám megnövekedett permeabilitásának köszönhető. A későbbiekben nemcsak a hatóanyagok farmakodinamikai aktivitását vizsgálták, hanem mérték a farmakon koncentrációját a cerebrospinális folyadékban is, és összevetették a nazális hatóanyagbevitelt placebo bejuttatással. Többek között Fehm és munkatársai, Quay, illetve Merkus végeztek ilyen klinikai vizsgálatokat.
3. A nazális úton agyba történő hatóanyag-bevitelt befolyásoló formulációs tényezők
Mint azt már a bevezetőben is leírtuk, a hatóanyagok agyba juttatásáról általánosságban elmondható, hogy a vízoldékony, illetve a 400-500 Da molekulatömegnél nehezebb molekulák transzportja minimális, ezen felül a vér-agy gát efflux transzporterei is megakadályozzák bizonyos vegyületcsoportok bejutását [1]. Ezért alternatívát nyújt a nazális útvonal kihasználásával a vér-agy gát megkerülése. Azonban a hatóanyag-bevitel befolyásolásának érdekében szükség van a nazális útvonal anatómiai sajátosságain kívül egyéb jellemzők ismeretére is. Az orrnyálkahártya Bowman-mirigyei és a kehelysejtek folyamatosan sűrű, viszkózus nyálkát termelnek, ami beborítja az epitéliumot. A laphámsejtek csillóinak permanens, egyirányú ostorozó mozgása a garat felé irányítja a nyákot és a beleragadt szennyeződéseket. Ezt nevezzük mukociliáris tisztulásnak, és ez ahhoz vezet, hogy 15-20 perc alatt gyakorlatilag a teljes nyálkaréteg megújul. A mukociliáris tisztulás a különböző légúti fertőzések elkerülése érdekében rendkívül fontos jellemzője az orrnyálkahártyának, viszont az intranazális hatóanyag-bevitel szempontjából egy leküzdendő probléma, ugyanis a hatékony gyógyszerbejuttatás eléréséhez szükséges, hogy a farmakon hosszabb ideig tartózkodjon a szaglóhám felszínén. A bioadhézió régóta ismert jelenség, azonban csak a XX. század végére találtak a működésére elfogadható magyarázatot. A jelenleg elfogadott diffúziós teória szerint fizikai keveredés szükséges a nyákréteg és a bioadhezív anyag flexibilis polimer-láncai között, mely úgy valósul meg, hogy a porózus struktúrájú mukoadhezív polimer pórusaiba hatol a nyák. Számos olyan mukoadhezív karakterű anyagot ismerünk, mely alkalmas hatóanyagok különböző nyálkahártyákhoz, esetleg adott sejttípushoz történő tapadásának növelésére. Ilyenek például a cellulóz alapú polimerek, az etilén-glikol polimerek, a polivinilalkohol, a polilaktidok, a poliglikolidok és a hialuronsav-észterek. A bioadhézió specificitása fokozható olyan ligandok alkalmazásával, amelyek a hordozó polimerhez kapcsolva fokozzák az adott nyálkahártya-, illetve sejttípushoz a hatóanyag-leadó rendszer adhézióját. Ilyen ligandok például a lektinek, a bakteriális adhezinek, különböző aminosavszekvenciák valamint az antitestek. Bioadhezív rendszerekben kedvelt segédanyag még a kitozán, mivel pozitív töltése miatt képes a nyákhoz tapadni [4]. A nátrium-hialuronsav a hialuronsav nátrium sója, ami egy nem szulfatált glükózaminoglikán. Jól ismert, természetes mukoadhezív anyag, amely az állati és emberi kötőszövetekben, epitéliumban és idegszövetben általánosan előfordul. Diszacharid egységekből áll, amelyek D-glükuronsavból és N-acetil-D-glükózaminból épülnek fel. A hialuronsav fontos a vízháztartás szabályozásában, vizes közegben a sejtek számára támasztó funkciót tölt be, valamint egyéb anyagok permeabilitását szabályozza és a lubrikációban is jelentős szerepe van. Higroszkópos karakterű anyag, saját tömegéhez képest akár 1800-szoros mennyiségű vizet is képes megkötni. Jól oldódik vízben, vizes oldata átlátszó, igen nagy viszkozitású. Ez a természetes anionos poliszacharid kiváló mukoadhezív tulajdonságokkal rendelkezik és az is valószínűsíthető, hogy növeli a nyálkahártyán keresztüli abszorpciót. Ezen kedvező tulajdonságok miatt esett erre az anyagra kutatócsoportunk választása az intranazális kísérleteinkhez. Kutatócsoportunk 2008-ban igazolta, hogy a nazális útvonalon keresztüli hatóanyag bejuttatás nagymértékben függ a hordozó összetételétől [8]. Célul tűztük ki olyan mukoadhezív vivőanyag kidolgozását, ami segíti a hatóanyagot tartalmazó formula megtapadását a szaglóhám felületén, ugyanakkor abszorpciófokozó alkalmazásával az agyba kerülő hatóanyag mennyisége tovább növelhető. Vizsgáltuk a vivőanyag viszkozitási, gyógyszer kioldódási paramétereit, valamint állatkísérletekben is teszteltük hatékonyságát. In vivo kísérleteinkben patkányokon teszteltük a kifejlesztett mukoadhezív hordozót, mely viszkozitást növelő nátrium-hialuronsavat és abszorpciófokozó anyagot (Cremophor RH40) tartalmazott. Modellanyagként fluoreszcein-izotiocianáttal jelölt 4 kDa molekulatömegű dextránt (FITC-dextrán) használtunk, amely egy nagyméretű hidrofil vegyület, amely igen alacsony mértékben jut át a vér-agy gáton. Négy eltérő összetételű hordozót hasonlítottunk össze: (1) fiziológiás sóoldatot, (2) abszorpciófokozót tartalmazó oldatot, (3) nátrium-hialuronsav vizes oldatát, illetve (4) hialuronsavat és abszorpciófokozót egyaránt tartalmazó mukoadhezív vivőanyagot. A FITC-dextrán modellanyagot a vivőanyagban feloldva altatott patkányok jobb orrüregébe juttattuk, majd a kísérleti állatokban 30, 60, 120, 240, 480 perc után vizsgáltuk a szérumban és az agyrégiókban a farmakokinetikát. A különböző agyrégiókat fluoreszcens spektroszkópiával megvizsgálva eltérő modellanyag koncentrációkat mértünk a különféle vivőanyagok esetében. Legmagasabb tesztanyag-koncentrációt a mukoadhezív vivőanyag esetében mértünk a szaglógumókban 240 perccel az intranazális kezelést követően. Jóllehet a mérések alapján a FITC-dextrán koncentráció csökkent az orrüregtől távolodva, mégis a mukoadhezív hordozó alkalmazásával minden vizsgált agyterületen szignifikánsan magasabb volt, mint a többi vivőanyag esetén. Eredményeink egybecsengenek korábbi vizsgálatokkal [9], ahol a hatóanyagok nazális úton történő agyba jutásánál az orrüreg és a központi idegrendszer közötti lehetséges transzport utakat vizsgálták (4. ábra). Mind a Thorne és mtsai által végzett vizsgálatok [9], mind a saját eredményeink [8] valószínűsítik a nazálisan beadott molekuláknak a szagló- és a háromosztatú idegek mentén, valamint az agy-gerincvelői folyadéktérben történő diffúzióval való eljutását a különböző agyterületekre. Egy újabb kísérletsorozatban mukoadhezív és abszorpciófokozó komponenseket egyaránt tartalmazó vivőanyagot felhasználva a bioaktív β-amiloid peptidet is sikeresen bejuttattuk intranazális úton patkányok agyába. A bejutást magatartásvizsgálatokkal is igazoltuk. Eredményeink alapján célunk egy új, a jelenlegieknél egyszerűbben kialakítható állatkísérletes Alzheimer-kór modell kidolgozása, ami megkönnyíthetné a betegség tanulmányozását.
4. Jövőkép
Számos tanulmány, és saját kísérleteink is alátámasztják, hogy hatóanyagok intranazális agyba juttatása nagy potenciállal bíró, de egyelőre nem teljesen kiaknázott terület. Noha állatkísérletekben a módszer hatékonyan működik, humán gyógyászatban szükséges a transzport hatékonyságának növelése új, mukoadhezív és az abszorpciót, illetve a transzportot fokozó vivőanyagok alkalmazásával. A hatás fokozásához lehetséges különféle szoros kapcsolatot módosító anyagokat is alkalmazni Ilyenek például a zárókapcsolat fehérjékre közvetlenül ható virális vagy bakteriális toxinokból előállított peptidek, a hisztamin, a ciklodextrinek, vagy a hiperozmotikus oldatok [3]. A továbbiakban is folytatni kívánjuk ilyen irányú kísérleteinket a Szegedi Biológiai Központban és a Szegedi Tudományegyetem Gyógyszertechnológiai Intézetében, együttműködésben a Tübingeni Egyetem Patológiai Intézetével.