KIÉ A KORONA?
A keringő exoszómáknak jelentős szerepe van a SARS-CoV-2 fertőzésben
A SARS-CoV-2 új koronavírussal fertőzött szervezetnek az infekcióra adott válaszra vonatkozó ismeretek továbbra is korlátozottak, ami akadályozza a COVID-19 patogenezisének megértését és a terápiás stratégiák kidolgozását. A vírusfertőzés során a gazdasejtekben exoszómák szabadulnak fel, és ezek mellett más extracelluláris vezikulák kibocsátása is történik, amelyek olyan vírusos és gazdaszervezeti komponenseket hordoznak, amelyek módosíthatják az immunválaszt. Jelen tanulmányban shotgun proteomikai megközelítést alkalmaztunk a gazdaszervezet keringő exoszómáinak a SARS-CoV-2 fertőzésre adott válaszának feltérképezésére. Megvizsgáltuk, hogy a SARS-CoV-2 fertőzés hogyan befolyásolja az exoszómák tartalmát, azt, hogy az exoszómák milyen szerepet játszanak a betegség progressziójában, és hogy a plazma exoszómák a betegség súlyosságának biomarkereiként használhatók-e.
A betegektől származó exoszómák proteomikai elemzése számos olyan molekulát azonosított, amelyek hozzájárulnak az immunreakcióhoz, a gyulladásos folyamatokhoz, valamint a véralvadási és szövődményi folyamatok aktiválódásához, vagyis azokhoz a főbb tényezőkhöz, amelyek közreműködnek a COVID-19-hez társuló szövetkárosodásokhoz és a több szerv működési zavarához.
Ezenkívül számos potenciális biomarker - például a fibrinogén, a fibronektin, a komplement C1rs-alkomponens és a szérum amiloid P-komponens – a görbe alatti (AUC) területen bizonyult diganosztikus tulajdonságúnak.
A betegség súlyosságával összefüggésben álló fehérjéket is felfedeztünk. Ezen túlmenően először azonosítottuk a SARS-CoV-2 RNS jelenlétét az exoszomális transzportban, ami arra utal, hogy a vírus az endocitózis útját használhatja a fertőzés terjesztésére.
Eredményeink arra utalnak, hogy a keringő exoszómák jelentősen hozzájárulnak számos folyamathoz - például a gyulladáshoz, a véralvadáshoz és az immunmodulációhoz - a SARS-CoV-2 fertőzés során.
1 Bevezetés
Az új koronavírusos betegség (COVID-19) jelenleg több mint egymillió halálesetért felelős világszerte (COVID-19 Data in Motion, 2020). A kórkép klinikai képe leírása igazi kihívást jelent, mert a fertőzést követően a tünetmentes formától enyhe vagy közepes mértékű légúti fertőzése tünetein át az atípusos tüdőgyulladásban szenvedő betegekig terjedő képet mutat.
Az akut légzési distressz szindróma (ARDS) sajátos jellemzői intenzív osztályra való beutalást és gépi lélegeztetést tesznek szükségessé. Bár a légzési elégtelenség a súlyos COVID-19-es esetek leggyakoribb klinikai megjelenési formája, más szervek - köztük a vesék és a szív - működési zavarairól is beszámoltak (Wu és mtsai., 2020). A SARS-CoV-2 vírus több sejttípust is képes megfertőzni, beleértve a tüdőhámsejteket, a limfocitákat és más típusú leukocita-alcsoportokat (Bost et al., 2020). Továbbá Varga és munkatársai (2020) kimutatták, hogy a SARS-CoV-2 több szerv endotélsejtjeibe is bejuthat; nevezetesen az endotélfertőzés felelős a vírus disszeminációjáért és a koagulációs és véralvadási kaszkádok beindításáért, amelyek kulcsfontosságú elemei a gazdaszervezet tromboinflammatorikus válaszának és több szervi elégtelenség kialakulásának (Guglielmetti és munkatársai, 2020; Noris és munkatársai, 2020). Korábbi munkánkban átfogó, nem célzott metabolomikai és lipidomikai megközelítést alkalmaztunk a SARS-CoV-2 fertőzésre adott gazdaszervezeti válasz megragadására, és bizonyítékot szolgáltattunk arra, hogy a lipidek és a metabolikus diszfunkció erősen részt vesznek a COVID-19-ben (Barberis et al.,2020).
Tekintettel a COVID-19 változatos klinikai megjelenési formájára, a tudományos közösségnek folyamatosan bővítenie kell ismereteit az optimális megelőzésről, a korai diagnózisról és a megfelelő terápiás lehetőségekről.
Ebben a forgatókönyvben az extracelluláris vezikulák (EV-k) fontos eszközt jelenthetnek a COVID-19 kezelésében. Az EV-k a különböző aktivált sejttípusokból felszabaduló mikro-részecskék, és kulcsszerepet játszanak a sejtek közötti kapcsolat mechanizmusaiban azáltal, hogy a fehérjéket, receptorokat, lipideket, organellákat és genetikai anyagokat, például mRNS-t és mikroRNS-t közvetlenül a célsejtekbe juttatják.
Az EV-k különböző testnedvekben - többek között a plazmában, a vizeletben, a nyálban és a liquorban - vannak jelen, ami egyre nagyobb lehetőséget kínál az OMIC-technológiák alkalmazására a vírusfertőzésekre adott gazdaszervezeti válasz tanulmányozása és a biomarkerek felfedezése érdekében. A proteomikai technológiát széles körben használják az EV-k jellemzésére és tanulmányozására (Bandu et al., 2019; Choi et al., 2015; Xu et al., 2020; Adamo et al., 2019; Bonafede et al., 2019).
Az EV-k három fő családba sorolhatók:
1) exoszómák, amelyek multivezikuláris testekből származnak, méretük 30-150 nm között mozog;
2) mikrovezikulák vagy leváló vezikulák, amelyeket a sejtek egy membránszelektálási folyamat révén szabadítanak fel, amelyet olyan enzimek, mint a flippáz, floppáz és scramblasz segítenek elő, és az exoszómáknál nagyobb méret jellemzi őket (150-1000 nm); és
3) az apoptotikus testek, amelyek nagyobbak, mint az exoszómák és a mikrovezikulák, és amelyeket a programozott sejthalálon áteső sejtek bocsátanak ki (Camussi et al., 2013).
Az elmúlt években az EV-k izolálásának és jellemzésének protokolljai jelentősen javultak (Théry és mtsai., 2018), ami új lehetőségeket kínál mind biomarkerként, mind számos emberi betegség közvetítőjeként betöltött szerepük vizsgálatára (Maione és mtsai., 2020). E megfontolások alapján e tanulmány célja az volt, hogy jellemezze - proteomikai elemzéssel - az exoszómák tartalmának bármilyen változását SARS-CoV-2 fertőzéskor, valamint a plazma exoszómák lehetséges felhasználását biomarkerként a SARS-CoV-2 fertőzés súlyosságának monitorozására. Ezen túlmenően az olyan folyamatokban, mint az immunválasz és a gyulladás, valamint a véralvadási és komplement útvonalak aktiválása, szerepet játszó számos molekula azonosítása, a keringő exoszómák összefüggésbe hozhatóak a COVID-19 által okozott szöveti károsodással és több szervi diszfunkcióval.
2 Eredmények
2.1 Az exoszómák SARS-CoV-2 RNS-t hordoznak magukban
A vírus RNS jelenlétét az exoszómák rakományában reverz transzkripciós-trófeás digitális polimeráz láncreakció (RT-ddPCR) segítségével vizsgáltuk. Az RT-ddPCR lehetővé teszi a dinamikatartomány jelentős növelését, miközben csökkenti az elemzés költségeit. Emellett érzékenyebb, mint a qPCR, és pontosabb adatokat szolgáltat - különösen alacsony célkopiaszámok esetén (Rački és mtsai., 2014). A kritikus és nem kritikus betegekből tisztított exoszóma-tartalom elemzése kimutatta a SARS-CoV-2 RNS jelenlétét az exoszómális rakományban. A vírusanyagot 15 és 88 kópia/10 µl között találtuk, a két csoport között nem volt szignifikáns különbség. Egészséges alanyokban nem mutattunk ki vírusanyagot.2.1 Az exoszómák beépítik a SARS-CoV-2 RNS-t.
2.2. A COVID-19 betegekből származó plazma-exoszómák proteomikai elemzése
Nem célzott proteomikai elemzést végeztünk 17 SARS-CoV-2-pozitív beteg és hét egészséges kontrollszemély plazmából származó exoszómáin. A vizsgálatba bevont betegek Észak-Olaszországban éltek, amely a COVID-19 járvány olaszországi epicentruma volt.
Betegcsoportunkat két csoportra osztottuk: kritikus (légzési elégtelenségben szenvedő, intenzív osztályra felvett, gépi lélegeztetést igénylő betegek) és nem kritikus (minden más beteg, enyhe vagy súlyos légzési elégtelenségben szenvedő, oxigénpótlást igénylő, de sem invazív, sem nem invazív gépi lélegeztetést nem igénylő betegek). A 17 betegből hét beteg volt kritikus állapotban, 10 pedig nem kritikus állapotban. A kritikus állapotú COVID-19 betegek vérében a fehérvérsejtek (WBC) és az eozinofilek szintje szignifikánsan magasabb volt, mint a nem kritikus állapotú betegeké. Ezzel szemben a nem kritikus COVID-19 betegeknél a vörösvértestek és a limfociták számának enyhe emelkedését találtuk (S1. kiegészítő táblázat).
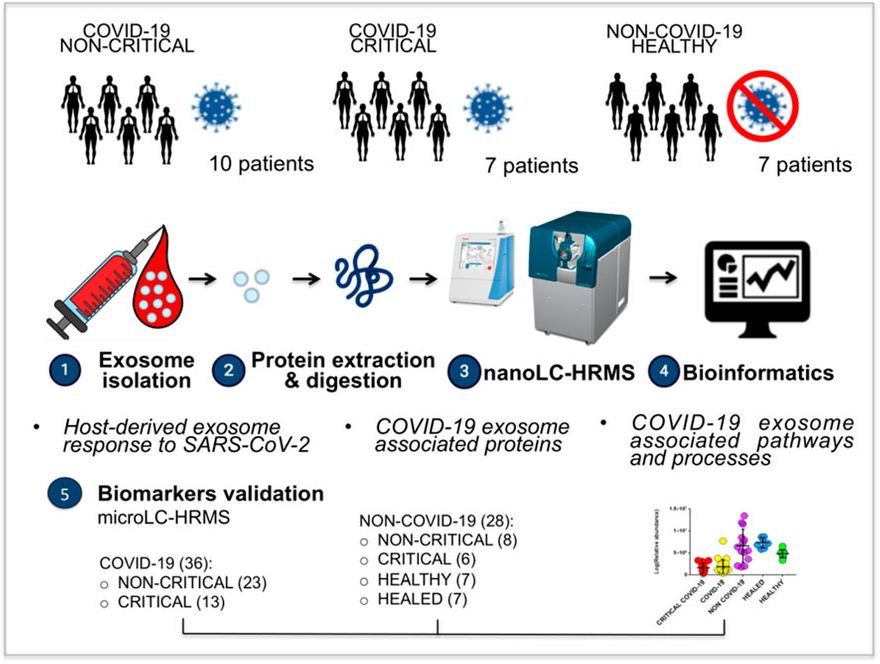
Az 1. ábra ismerteti a tanulmány kísérletének felépítését. Az exoszómákat a plazmából izoláltuk. Az exoszómák tisztítását több ellenőrző elemzésnek vetettük alá. Nanoszűrést és Western blot módszert alkalmaztunk a tisztítási módszer minőségének karakterisztizálására; ezek az elemzések, amelyeket biztonsági okokból csak egészséges alanyokon végeztünk, megerősítették a 30 és 100 nm közötti méretű (csúcs 37,70 ± 3 nm) és 3x1011 részecske/ml koncentrációjú exoszómák izolálását (S1. kiegészítő ábra). Ezen túlmenően a CD9 és CD63 tipikus exoszóma markereket is kimutattuk, ami megerősítette, hogy ezek a vezikulák exoszómák.
1. Ábra. A vizsgálat kísérleti tervének áttekintése: 10 nem kritikus COVID-19 beteg, hét kritikus COVID-19 beteg és hét egészséges személy plazma-exoszómáit izoláltuk egy kommersz csomag segítségével. Az exoszómák fehérjetartalmát proteomikai elemzéssel (nanoLC-HRMS) elemeztük, és az azonosított és modulált fehérjéket bioinformatikai módszerekkel is feldolgoztuk annak érdekében, hogy azonosítsuk a gazdaszervezet által a SARS-CoV-2-re adott exoszómaválaszt és a hozzá kapcsolódó folyamatokat. Az elemzés új biomarkerek jelenlétére utalt. A potenciális exoszómális biomarkerek validálását egy külső betegcsoporton végeztük el, proteomikai megközelítéssel, microLC-HRMS-en. 36 COVID-19 beteget, köztük nem kritikus (23) és kritikus (13) alanyokat, valamint 28 nem COVID-19 beteget, köztük 6 kritikus beteget, 8 nem kritikus beteget, 7 egészséges alanyt és 7 gyógyult COVID-19 alanyot vizsgáltunk.
Az exoszómális fehérjéket ezután kivontuk, feltártuk és nanofolyadék-kromatográfia/tandem tömegspektrometria (nanoLC-MS/MS) segítségével elemeztük. Az eredményeket bioinformatikai eszközökkel feldolgoztuk, hogy kiemeljük a SARS-CoV-2 fertőzésre adott gazdaszervezeti válasszal kapcsolatos fő működéseket és folyamatokat. A potenciális biomarkerek validálását ezután mikroLC-MS/MS segítségével 36 COVID-19 betegen, köztük nem kritikus (23) és kritikus (13) alanyon, valamint 39 nem-COVID-19 betegen, köztük 6 kritikus, 8 nem kritikus, 7 egészséges és 7 gyógyult COVID-19 betegen végeztük el.
2.3 A COVID-19 betegek keringő exoszómái specifikus proteomikai jellegzetességekkel rendelkeznek
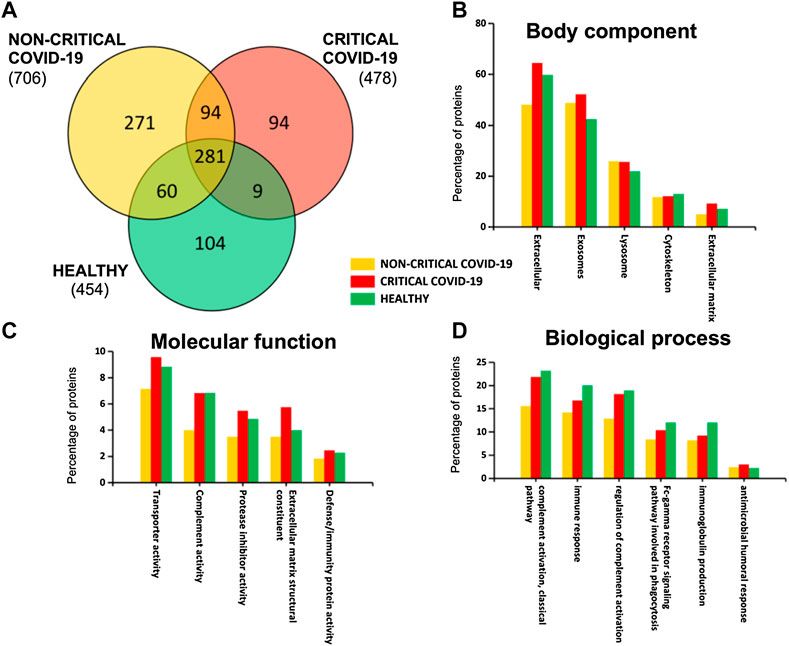
A SARS-CoV-2 fertőzés kialakulásában és a keringő exoszómák által közvetített esetleges immunmoduláló funkciókban potenciálisan szerepet játszó fehérjék azonosítása érdekében a különböző súlyosságú COVID-19 betegek plazma-exoszómáit shotgun proteomikai elemzéssel elemeztük. Összesen 913 különböző fehérjét azonosítottunk a plazma exoszómákban; ezek közül 281-et találtunk kritikus, nem kritikus és egészséges alanyokban, amint azt a 2. ábra mutatja. Érdekes módon a nem kritikus betegekre jellemző a nagyobb számú fehérje jelenléte (706), míg a kritikus betegeknél (478) és az egészséges alanyoknál szintén hasonló számú fehérjét azonosítottak (454) (S2. kiegészítő táblázat).
Plazma-exoszómák fehérjetartalma. A kritikus és nem kritikus COVID-19 betegek és egészséges személyek azonosított fehérjéinek Venn-diagramja (A). Az azonosított fehérjék génontológiai osztályozása a testkomponensek (B), a molekuláris funkció (C) és a biológiai folyamat (D) alapján szintén az azonosított fehérjékhez kapcsolódó funkciók értékelésére szolgált.
Az exoszomális rakományt elemezve azt találtuk, hogy azt elsősorban az extracelluláris, exoszomális, lizoszóma és citoszkeleton fehérjék jelenléte jellemzi (2B ábra). Továbbá ezek a fehérjék részt vesznek a transzportaktivitásban, a komplementaktivitásban, a proteáz inhibitor aktivitásban, az extracelluláris mátrix szerkezeti alkotóelemeiben és a védekezési/immunitási aktivitásban (2C ábra). Érdekes módon néhány fehérje az immunválaszhoz és a véralvadáshoz kapcsolódik (komplement aktivitás, immunválasz, a komplement aktiváció szabályozása, Fc-gamma receptor jelátviteli útvonal, immunglobulin termelés és antimikrobiális humorális válasz), amint azt a 2D ábra mutatja.
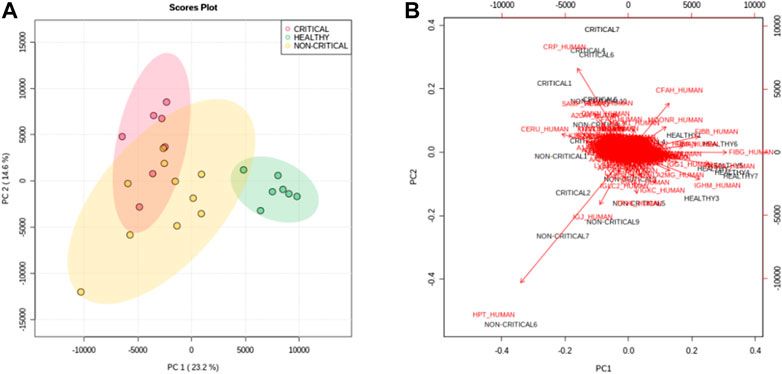
A COVID-19 betegek és az egészséges személyek exoszómái közötti általános különbségek felmérése érdekében a fehérjék mennyiségét többváltozós statisztikai elemzéssel elemeztük. A főkomponens-elemzés (PCA) - különösen az első és a második főkomponens – alapján az egyes csoportok egyértelműen elkülöníthetőek voltak egymástól. Az első komponens megmutatja a COVID-19 betegeket (piros és sárga pontok) és a nem COVID-19 alanyok (zöld pontok) közötti különbségeket, míg a második komponensből elsősorban a betegség súlyossága közötti különbségek láthatóak (3A. ábra). A 3B. ábra egy bi-plot, ami megmutatja a súlyosság szintjét az egyes hordozott fehérjékre vonatkozó információkat. A grafikon bemutatja azokat a fehérjéket, amelyek alapján a betegcsoportok elkülönülnek. Érdekes módon például a CRP fehérje (CRP_HUMAN) alapján elválaszthatóak egymástól a pozitív betegek a nem pozitív alanyoktól, de ugyanígy a kritikus állapotú betegeknek a nem kritikus állapotú betegektől való elkülönítésére is alkalmas.
Főkomponens-elemzés. A PC1 és PC2 pontszámdiagramja (A) egyértelműen elkülöníti az egészséges alanyokat (zöld pontok) a kritikus COVID-19 betegektől (piros pontok) és a nem kritikus (sárga pontok) COVID-19 betegektől. (B) A PC1 és PC2 pontszámok (fekete) és a terhelés (piros) bi-plotja a betegség súlyossága és a fehérjék expressziója közötti korrelációról számolt be.
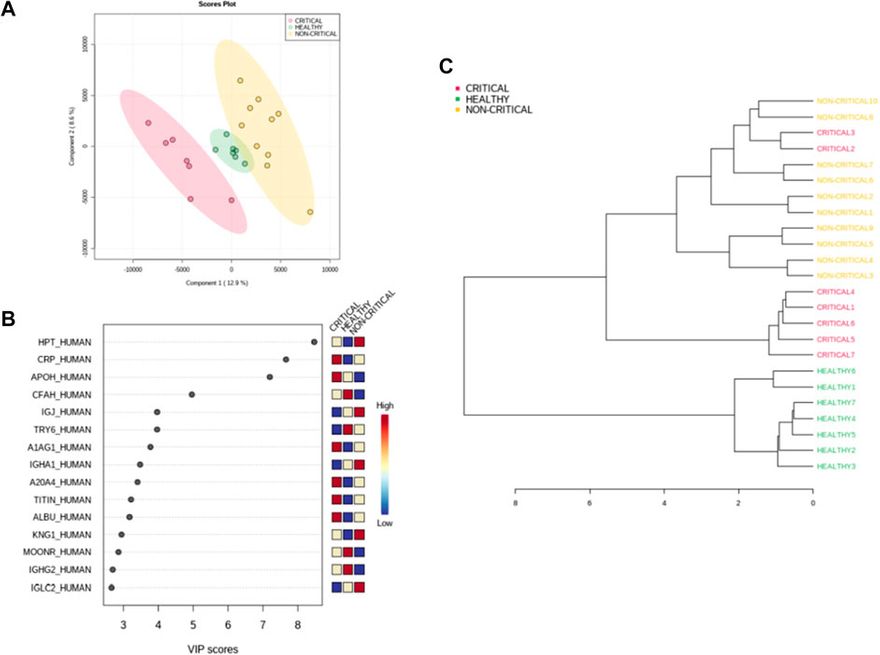
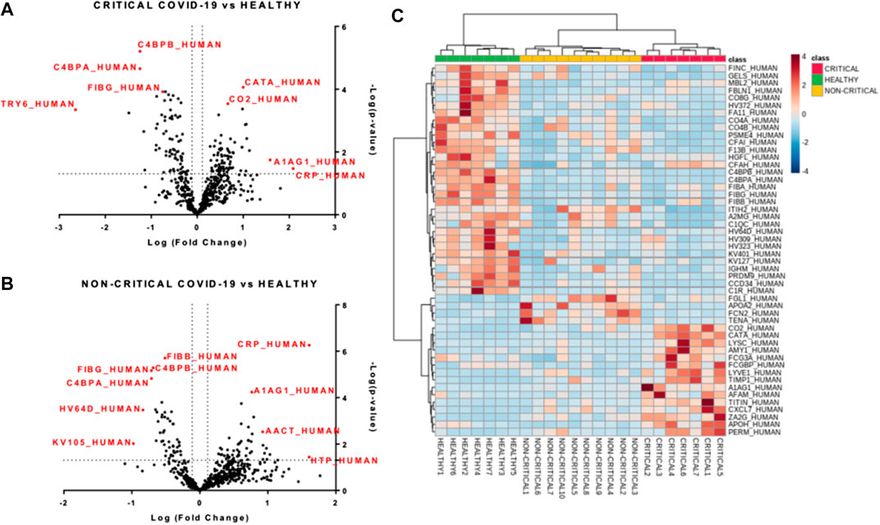
A mintákat felügyelt részleges legkisebb négyzet diszkriminancia-elemzéssel (PLS-DA) is osztályoztuk, amelyet a két betegcsoport közötti maximális elkülönítés eléréséhez használtunk fel (4A. ábra). A minták osztályozását potenciálisan segítő, leginkább prediktív vagy diszkriminatív jellemzőket a VIP (variable of importance in projection) pontszám segítségével is meghatároztuk. A VIP-pontszám összefoglalta a COVID-19 plazmaexoszómákban megfigyelt fenotípusos eltérésekhez leginkább hozzájáruló kiemelkedő fehérjéket (4B. ábra). A három mintacsoport közötti proteomikai különbségek leginkább a haptoglobin (HPT_HUMAN), a C-reaktív fehérje (CRP_HUMAN), a béta-2-glikoprotein 1 (APOH_HUMAN) és a komplement faktor H (CFAH_HUMAN) kapcsán mutatkoztak. A kritikus betegek (piros), a nem kritikus betegek (sárga) és az egészséges alanyok (zöld) exoszómáiból származó fehérjék mennyiségének hierarchikus csoportosítását mutató hierarchikus klaszterezés dendrogramja megerősítette, hogy az exoszómális fehérjék korreláltak a SARS-CoV-2 fertőzéssel és a betegség súlyosságával (4C. ábra).
Modulált exoszomális fehérjék a SARS-CoV-2 fertőzésben. A számszerűsített fehérjék (A és B) volcano-diagramjai, amelyek a p-értéket és a hajtásváltozást jelentik. A kritikus (A) és a nem kritikus (B) COVID-19 betegeknél összesen 157, illetve 97 fehérje modulálódott (p-érték < 0,05 és hajtásváltozás > 1,3). A kvantifikált fehérjék hierarchikus hőtérképei (C), amelyek kiemelik a minták három klaszterét: a kritikus COVID-19 betegek piros színnel, a nem kritikus COVID-19 betegek sárgával, az egészséges alanyok pedig zölddel.
2.4 Az exoszomális fehérjék jelentős szerepet játszanak a SARS-CoV-2-re adott gazdaszervezeti válaszban
Ezután elvégeztük a mért fehérjék egyváltozós elemzését az összes mintában számszerűsített 518 fehérje relatív gyakoriságának felhasználásával. Összesen 157 fehérje módosult a kritikus COVID-19 betegek exoszómáiban az egészséges alanyokhoz képest, míg a nem kritikus betegeknél 97 fehérje volt szabályozott (p-érték < 0,05,="" hajtásváltozás=""> 1,3). A volcano-diagramok (5A. ábra és 5B. ábra) mutatták a fehérjék közötti legjelentősebb különbségeket és az egészséges csoporthoz képest a kritikus és nem kritikus COVID-19 betegek exoszómáiban bekövetkezett pozitív vagy negatív mértékű változásokat. Az egyváltozós eredmények összegzésére hőtérképet (5C. ábra) használtunk a legjobban modulált fehérjék változásainak megjelenítésére. Ez a hőtérkép lehetővé tette a minták három klaszterének és a különböző fehérjeszinteknek a vizualizálását. A modulált fehérjék teljes listáját az S1, S2 kiegészítő táblázatokban közöljük. A kritikus és nem kritikus betegeknél az egészséges alanyokhoz képest a legjobban modulált fehérjék között főként gyulladásos, immunválasz- és véralvadási fehérjék szerepeltek. A kritikus betegeknél a C-reaktív fehérje (122-szeres), az alfa-1-sav glikoprotein 1 (38-szoros), a lizozim C (13-szoros), a titin (12-szoros) és a cink-alfa-2-glikoprotein (12-szoros) emelkedett, míg a putatív tripszin-6 (31-szeres), a 34-es coil-tekercs domént tartalmazó fehérje (18-szoros), a C4b-kötő fehérje alfa-lánc (18-szoros), a C4b-kötő fehérje béta-lánc (15-szoros) és a 19-es pre-mRNS-feldolgozó faktor (14-szoros) alacsonyabb szinten voltak. A nem kritikus COVID-19 betegek körében az öt leggyakrabban megemelkedett fehérje a haptoglobin (41-szeres), a C-reaktív fehérje (40-szeres), a tripszin-3 (14-szeres), az adenomatosus polyposis coli fehérje (11-szeres) volt, és a hialuronsav-kötő fehérje 2 (10-szeres), míg az immunglobulin kappa-változók 1-5 (10-szeres), az immunglobulin nehézváltozók 3-64D (7-szeres), a fibrinogén gamma-lánc (5-szeres), a C4b-kötő fehérje alfa-lánc (5-szeres) és a C4b-kötő fehérje béta-lánc (5-szeres) alul-expresszáltak.
Modulált exoszomális fehérjék a SARS-CoV-2 fertőzésben. A számszerűsített fehérjék (A és B) volcano-diagramjai, amelyek a p-értéket és a hajtásváltozást jelentik. A kritikus (A) és a nem kritikus (B) COVID-19 betegeknél összesen 157, illetve 97 fehérje modulálódott (p-érték < 0,05 és hajtásváltozás > 1,3). A kvantifikált fehérjék hierarchikus hőtérképei (C), amelyek kiemelik a minták három klaszterét: a kritikus COVID-19 betegek piros színnel, a nem kritikus COVID-19 betegek sárgával, az egészséges alanyok pedig zölddel.
2.5 A COVID-19 betegek keringő exoszómái módosíthatják az immunválaszt, a gyulladást és a véralvadási folyamatokat
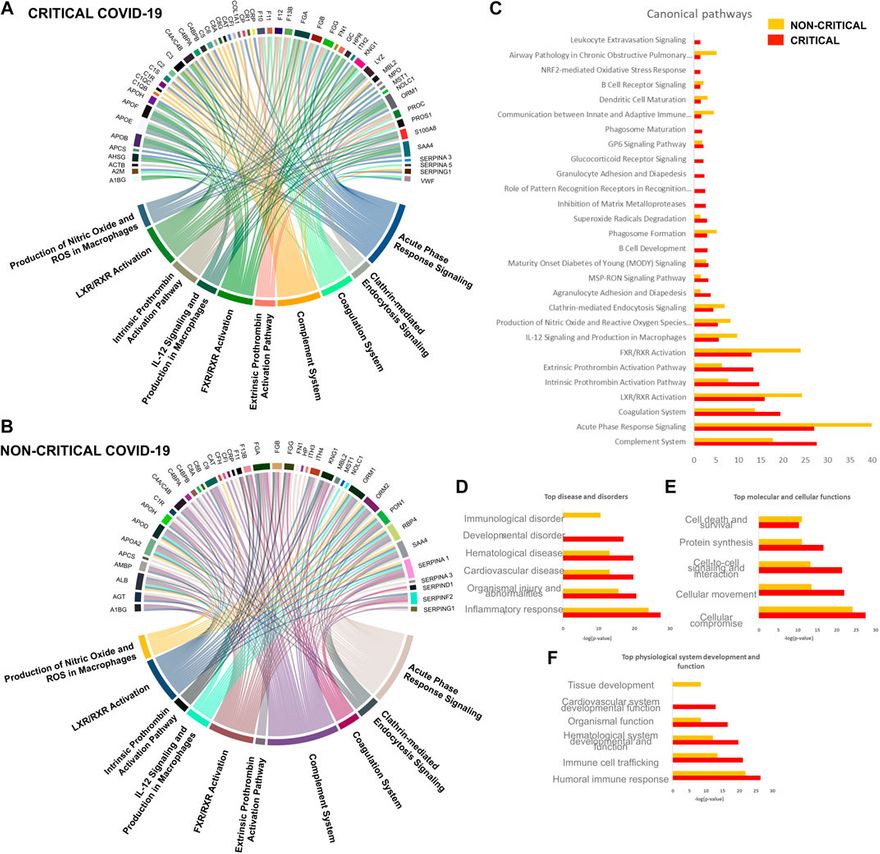
A COVID-19 betegek exoszóma-proteomikai reakciójának globális áttekintése érdekében a modulált fehérjéket bioinformatikai eszközökkel elemezték. Az Ingenuity folyamatelemzést (IPA) alkalmaztuk a SARS-CoV-2 fertőzéssel kapcsolatos fő folyamatok, biológiai folyamatok, molekuláris funkciók és sejtkomponensek azonosítására. A gazdaszervezet válaszában részt vevő egy-egy lehetséges folyamat főként az immunválaszhoz, a gyulladáshoz és a véralvadáshoz kapcsolódott. A 6A,B ábrán látható diagramok a kritikus (6A) és a nem kritikus (6B) betegeknél érintett 10 legfontosabb folyamatról és a hozzájuk tartozó releváns fehérjékről számolnak be. A nem kritikus és a kritikus betegeknél érintett fő jelátviteli útvonalak a következők voltak: a komplementrendszer jelátviteli útvonala, az akut fázisválasz jelátvitel, a véralvadási rendszer, az LXR/RXR aktivációs útvonal, az extrinsic és intrinsic prothrombin aktivációs útvonal, az FXR/RXR aktivációs útvonal, az IL-12 jelátvitel és termelés a makrofágokban, a nitrogén-oxid és a reaktív oxigénfajok termelése a makrofágokban, valamint a klatrin-mediált endocitózis jelátvitel. Amint a 6C. ábra mutatja, néhány útvonal jobban megváltozott a nem kritikus betegeknél - konkrétan az akut fázisválasz jelátvitel, az LXR/RXR és az FXR/RXR aktiváció. Eközben más útvonalak - például a komplementrendszer, a véralvadási rendszer és az extrinsic és intrinsic protrombin aktivációs útvonal - jobban megváltoztak a kritikus betegeknél.
A SARS-CoV-2 fertőzésre adott gazdaszervezeti exoszóma-válasz. A keringő exoszómákat a gyulladásban, az immunválaszban és a véralvadásban részt vevő fehérjék és útvonalak jellemzik.
2.6 Upstream elemzés kiemelte a gyulladás és a fehérje szállítmányok közötti kapcsolatot
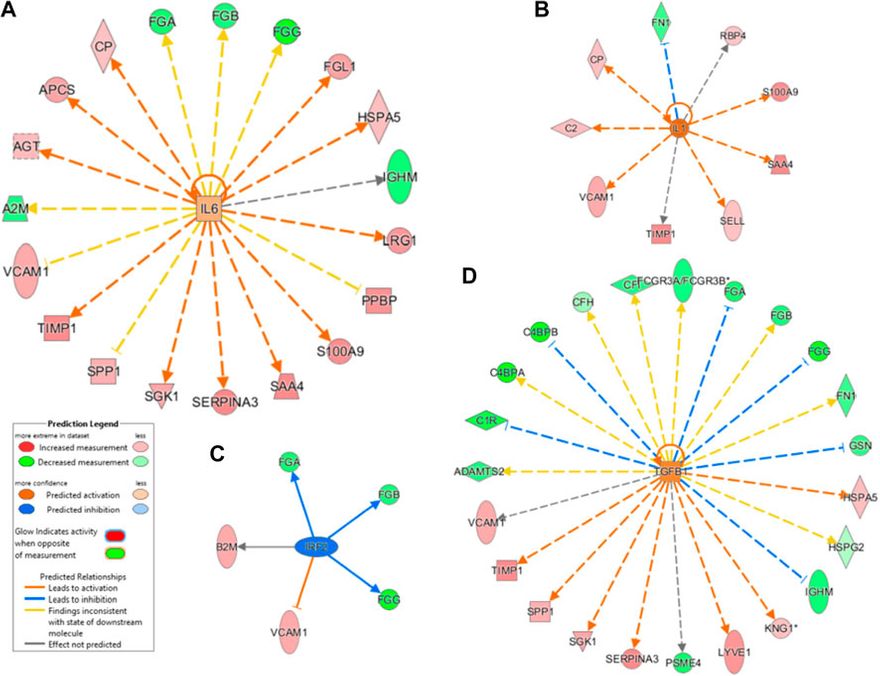
2.6 Upstream elemzés kiemelte a gyulladás és a fehérje szállítmányok közötti kapcsolatot Az upstream molekulák (transzkripciós faktor, mikroRNS stb.) előrejelzésére, amelyek szerepet játszhatnak a megfigyelt proteom-modulációban és ezáltal a SARS-CoV-2 fertőzésre adott gazdaszervezeti válaszban, upstream szabályozói elemzést végeztünk IPA szoftver segítségével. Az IPA-elemzés azt mutatta, hogy az IL-6 interleukin (IL-6) és a transzformáló növekedési faktor (TGF)-béta1 (TGFB1) a legjelentősebb upstream szabályozók (7A. ábra és 7C. ábra). A többi upstream szabályozó közül az IL-1-et szignifikánsan aktivált szabályozónak jelöltük (z score=2,6), míg az IRF2-t gátolt szabályozónak (z score=-2,0) jeleztük előre, amint azt a 7B,D ábra mutatja.
Kanonikus útvonalelemzés. A SARS-CoV-2 fertőzésre válaszul a kritikus (A) és a nem kritikus (B) betegeknél szignifikánsan megváltozott fehérjék útvonalelemzését bemutató akkorddiagram. Az egyes útvonalak szélességét az egyes útvonalakhoz kapcsolódó fehérjék száma határozza meg. A kanonikus útvonalak szignifikanciáját (-log(p-érték)) is összehasonlítottuk (C): ez az elemzés hasonló exoszómaválaszokat mutatott a kritikus és nem kritikus betegeknél. A betegségek és rendellenességek elemzése (D), a molekuláris és sejtfunkciók (E), valamint a fiziológiai rendszerek fejlődése és funkcióinak kidolgozása (F) is látható.
Az IL-6 célzott gének (FGA, FGB, FGG, FGL1, HSPA5, IGHM, LRG1, PPBP, S100A9, SAA4, SERPINA3, SGK1, SPP1, TIMP1, VCAM1, A2M, AGT, APCS és CP) és a TGFB1 célzott gének (VCAM1, TIMP1, SPP1, SGK1, SERPINA3, PSEM4, LYVE1, KNG1, IGHM, HSPG2, HSPA5, GSN, FN1, FGG, FGB, FGA, FCGR3A/FCGR3B, CP, CFH, C4BPB, C4BPA, C1R és ADAMTS2) hozzájárulhatnak a SARS-CoV-2-vel kapcsolatos működési zavarokhoz. Mint fentebb említettük, e szabályozott gének többsége részt vesz a gyulladásban, az immunválaszban és a véralvadásban.
2.7 Az exoszóma rakomány és a patológiailag releváns klinikai mutatók társulása
Ezt követően megvizsgáltuk, hogy a COVID-19-es betegek exoszómális fehérje rakománya szignifikánsan korrelál-e a CRP- és d-dimer-szintekkel, valamint a vérlemezkék, neutrofilek és monociták számával. Spearman-féle korrelációkat végeztünk, és csak a p < 0,05="" értékű="" korrelációkat="" vettük="" figyelembe,="" amelyeket="" a="" kiegészítő="" s5-s9="" táblázatban="" mutatunk="">
Megállapítottuk, hogy a keringő CRP-szint pozitívan korrelált a CRP, IBP2, CHI3L1, FGB, FHR5, IGHV3-73, FGG, PRSS2, CFP, CFH, CD163, FCGBP és CAT exoszómális fehérjékkel, amelyek a gyulladáshoz, komplementaktivációhoz és tüdőfibrózishoz kapcsolódnak (Lu és mtsai., 2011). A fibronektin, az alfa-2-HS-glikoprotein és az alfa-1-sav glikoprotein 1 fehérje pozitívan korrelált a d-dimer szintekkel, a vérlemezkeszám pedig pozitívan korrelált a TIMP1, COL6A3, SPINK1, IGFBP4, IGHV1-8, NCAM1, COL18A1, APOA2, CFB és MYH7 exoszomális fehérjékkel, amelyek részt vesznek a vérlemezkék aggregációjában, adhéziójában vagy aktiválásában és a komplement aktiválásában (Stecher és mtsai., 1986). Ami a neutrofilok számát illeti, a kritikus COVID-19 betegek körében a neutrofilok számának növekedését találtuk, és az exoszomális rakomány elemzésénél pozitív korrelációt mutattunk ki az FGA fehérjével, amely a neutrofilok aktiválásában játszik szerepet (Rubel és mtsai., 2001), de a TPI1 fehérjével is, amelyet már találtunk az exoszomális rakományban (Vargas és mtsai., 2016), valamint más gyulladásos fehérjékkel (pl. SAA1, XI. alvadási faktor stb.).
A monociták száma pozitívan korrelált az IGFALS, CFP, CLU és SERPINC1 exoszómális fehérjékkel, amelyek részt vesznek a humán monociták migrációjában és kemotaxisában (Peix és mtsai., 2018).
2.8 A keringő exoszómák a COVID-19 potenciális biomarkerei
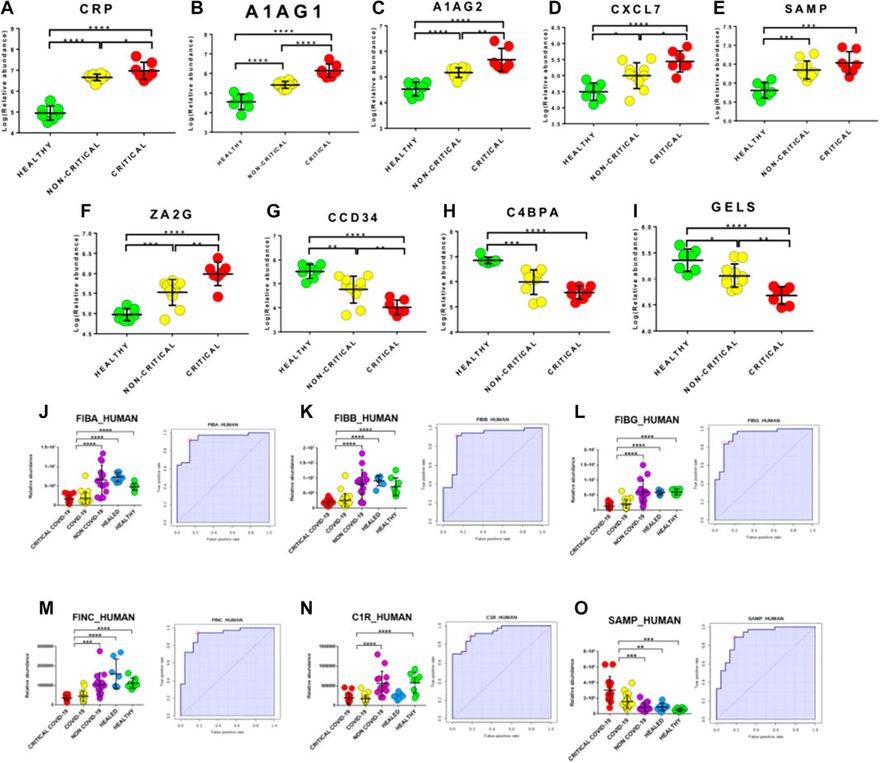
A potenciális biomarkerek feltárása a modulált fehérjék eloszlásának gondos elemzésével és ROC-görbék alkalmazásával történt. Először a felfedezési fázisból származó modulált fehérjéket értékeltük. Érdekes módon azt találtuk, hogy számos fehérje abundanciája közvetlenül korrelált a betegség súlyosságával. Különösen a kritikus betegeknél magasabb volt a CRP, A1AG1, A1AG2, CXCL7, SAMP és ZA2G szintje, és alacsonyabb a CCD34, C4BPA és GELS szintje, mint a nem kritikus betegeknél (8A-I. ábra). Ezen túlmenően ez az elemzés számos olyan fehérje jelenlétéről számolt be, amelyek képesek megkülönböztetni a COVID-19 betegeket az egészséges alanyoktól.
Upstream génszabályozó elemzés. Az IL-6 (A) és a transzformáló növekedési faktor (TGF)-béta1 (B) a legjelentősebb upstream szabályozók. Az IL-1 szignifikánsan aktivált (z score2,6), míg az interferon szabályozó faktor 2 gátolt szabályozónak (z score-2,0) bizonyult.
A biomarkereket egy új betegcsoporton validálták, amely nem csak COVID-19 kritikus (n=13) és nem kritikus (n=26) betegeket és egészséges alanyokat (n=7), hanem kritikus (n=6) és nem kritikus (n=8), tüdőgyulladás és/vagy légzési elégtelenség miatt felvett, negatív nukleinsav-teszt eredménnyel rendelkező (NON-COVID-19) és COVID-19 gyógyult betegeket (n=7) is tartalmazott. Érdekes módon a fibrinogénfehérjék fibrinogén alfa-lánc (FIBA_HUMAN), fibrinogén béta-lánc (FIBB_HUMAN) és fibrinogén gamma-lánc (FIBG_HUMAN) AUC-értéke 0 volt. 94 (érzékenység (SE): 86%; specificitás (SP): 97%), 0,90 (érzékenység (SE): 92%; specificitás (SP): 86%) és 0,93 (érzékenység (SE): 83%; specificitás (SP): 91%) értéket mutatott. Ezenkívül a fibronectin (FINC_HUMAN), a komplement C1r alkomponens (C1R_HUMAN) és a szérum amiloid P-komponens (SAMP_HUMAN) 0,92 (érzékenység (SE): 94%; specificitás (SP): 82%), 0,93 (érzékenység (SE): 89%; specificitás (SP): 82%) és 0,91 (érzékenység (SE): 89%; specificitás (SP): 82%) AUC-értéket mutatott (8J-O ábra).
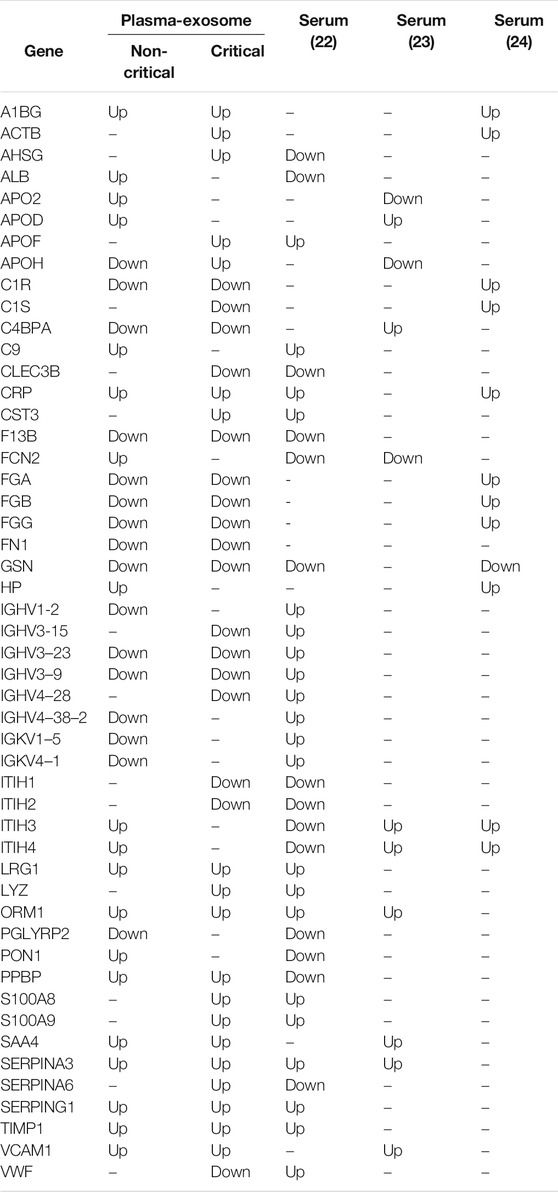
Összehasonlítottuk a COVID-19 betegeknél a modulált exoszómafehérjéket az irodalomban közölt szabályozott szérumfehérjékkel is (D'Alessandro és mtsai., 2020; Shen és mtsai., 2020; Messner és mtsai., 2020). Az 1. táblázat a gyakori differenciálisan expresszált fehérjék listáját közli. Érdekes módon a fehérjék több mint 50%-a (50-ből 27) ugyanazt a modulációs irányt mutatta, amelyet a szérumban keringő fehérjékkel kapcsolatos korábbi kutatások során azonosítottak - még akkor is, ha a plazma-exoszómában a hajtásváltozási szintek magasabbak voltak, mint a szérumban.
TÁBLÁZAT 1. A COVID-19 betegeknél a szakirodalomban közölt, modulált exoszómafehérjék és a szabályozott szérumfehérjék összehasonlítása. A fehérjemoduláció (felfelé vagy lefelé) van feltüntetve.
Összefoglalás
Ez a tanulmány a COVID-19 betegek és egészséges kontrollok plazmából származó exoszómáinak első proteomikai jellemzését nyújtja. A résztvevő betegeket egy észak-olaszországi kórházból választottuk ki, amely a COVID-19 világjárvány első nyugati epicentrumának számított. A kritikus állapotú COVID-19-es betegeknél megnövekedett a WBC-, neutrofil- és eozinofil-szám, míg a vörösvértestek, valamint a limfociták száma jelentősen csökkent (Terpos és mtsai., 2020). Az exoszómák és az EV-k jelentős szerepet játszanak a különböző biológiai funkciókban, és különösen az élettani és kóros folyamatokban (Zhang et al., 2019). Tény, hogy összefüggésbe hozhatók az immunválaszokkal, a víruspatogenitással, a terhességgel, a szív- és érrendszeri betegségekkel, a központi idegrendszerrel kapcsolatos betegségekkel és a rák progressziójával (Kalluri és LeBleu, 2020).
Számos tudományos példa bizonyította, hogy a vírusok az EV-ket használhatják a nem fertőzött sejtekbe való bejutáshoz (Urbanelli et al., 2019).
A fertőzések során az EV-k olyan kórokozó molekulákat szállíthatnak, amelyek antigénként vagy a veleszületett immunreceptorok agonistáiként szolgálnak a gazdaszervezet védelmének és immunitásának kiváltására, vagy a gazdaszervezet védelmének szabályozóiként és az immunelkerülés közvetítőiként szolgálnak (Kadiu és mtsai., 2012; Schorey és Harding, 2016).
Adataink első alkalommal számolnak be vírusanyag jelenlétéről a COVID-19 betegek gazdaszervezetének exoszomális rakományában. Ez a megállapítás arra utal, hogy a SARS-CoV-2 az endocitózis útját használhatja a fertőzésnek a gazdaszervezetben történő terjesztésére.
Nem azonosítottunk vírusfehérjéket az exoszómák megtisztítása révén, ami arra utal, hogy az RNS-anyag eredetileg a rakományban volt jelen.
Egy nagyon friss tanulmány kimutatta, hogy az exoszomális mikroRNS-ek a COVID-19 betegek trombózisát irányíthatják (Gambardella és munkatársai, 2020), míg Song és munkatársai azt találták, hogy a GM3-mal dúsított exoszómák pozitívan korreláltak a betegség súlyosságával, ami arra utal, hogy részt vehetnek a COVID-19 progressziójával járó patológiai folyamatokban (Song és munkatársai, 2020).
Ezenkívül exoszóma-alapú stratégiákat javasoltak a COVID-19 kezelésére (Hassanpour et al., 2020) vagy a SARS-CoV-2 fertőzés megelőzésére (Cocozza et al., 2020).
Eredményeink azt mutatják, hogy a keringő exoszómák fokozottan részt vesznek a SARS-CoV-2 fertőzéssel kapcsolatos folyamatokban. Érdekes módon a COVID-19 betegek plazmából származó exoszómáinak proteomikai elemzéseink egy specifikus proteomikai aláírást mutattak ki.
Ez a jelrendszer különösen nyilvánvalóvá vált a többváltozós statisztikai elemzés (PCA és PLS-DA) segítségével, amely rávilágított olyan proteomikai jellemzők jelenlétére, amelyek képesek egyértelműen megkülönböztetni a mintákat a diagnózisnak megfelelően. A bioinformatikai elemzés kimutatta a véralvadási folyamathoz, a transzportaktivitáshoz, a komplementaktivitáshoz, a proteáz-inhibitor-aktivitáshoz és a védelmi/immunfehérje-aktivitáshoz kapcsolódó fehérjék jelenlétét.
Érdekes módon az exoszómális fehérjék relatív abundanciája a COVID-19 betegeknél jelentősen különbözött az egészséges alanyokétól. Valójában 157 és 97 fehérje volt szignifikánsan modulált a kritikus és a nem kritikus COVID-19 betegeknél. A modulált fehérjéken elvégzett analízis során a modulált fehérjékkel végzett analízisünk az immunválaszhoz, a véralvadáshoz és a gyulladáshoz kapcsolódó útvonalak érintettségét mutatta ki, amint azt a 9. ábra összefoglalja.
Az exoszóma rakomány proteomikai elemzésével azonosított legjobb potenciális biomarkerek keretes ábrái és ROC-görbéi. Az (A-I) esetében a betegség súlyosságával jól korreláló fehérjék box-plotjai szerepelnek. A piros pontok a kritikus COVID-19 betegeket, míg a sárga pontok a nem kritikus COVID-19 betegeket jelölik. A fibrinogén alfa-lánc (J), fibrinogén béta-lánc (K), fibrinogén gamma-lánc (L), fibronektin (M), komplement C1r alkomponens (N) és szérum amiloid P-komponens (O) jó biomarkerekként igazolódtak a validálás során. A lila pontok a NON-COVID-19 betegeket jelzik, míg a zöld és kék pontok az egészséges, illetve a gyógyult alanyokat.
A véralvadás szerepéről a SARS-CoV-2 fertőzésben a COVID-19-ben széles körben beszámoltak (Palumbo és mtsai., 2020; Al-Samkari és mtsai., 2020). A SARS-CoV-2-fertőzött betegekben a vérlemezkék degranulációjában szerepet játszó fehérjéket lefelé szabályozták (Zheng és mtsi., 2020), a súlyos COVID-19-hez és a halálozáshoz társuló alacsony vérlemezkeszámmal együtt (Lippi és mtsi., 2020; Shen és mtsi., 2020). Bioinformatikai elemzésünk kimutatta, hogy az exoszomális fehérjék a véralvadási rendszer útvonalával, valamint az intrinzik és extrinsik prothrombin aktivációs útvonallal állnak kapcsolatban. A komplement faktorok képesek növelni a szöveti faktor aktivitását, prothrombinból aktivált trombint képezni, növelni a vérlemezkék aktivitását és aggregációját, fokozni a prothrombináz aktivitását, és felszabadítani a vérlemezkékből származó prokoaguláns granulumokat (Fletcher-Sandersjöö és Bellander, 2020).
A SARS-CoV-2 által a sejtbe jutáshoz használt vírusos ACE2 hatásai közül az ACE2 és a Kallikrein/Kinin rendszer - amely a véralvadást, a fibrinolízist és a komplement kaszkádot szabályozza - közötti kapcsolat nagy érdeklődést eredményezett (Colarusso és mtsai., 2020). Az ACE2 ugyanis fiziológiásan megköti és hasítja a Lys-des-Arg9-Bradykinint és a Des-Arg9 Bradykinint, amelyek a tüdőben a Bradykinin Receptor 1 erős ligandumai (van de Veerdonk és mtsai., 2020). Amikor a vírus blokkolja az ACE2-t, a bradikinin lebontása nem végezhető el, ami magának a bradikininnek a felhalmozódását okozza; következésképpen a bradikinin - a nagy molekulatömegű kininogén terméke - kötődik a receptorához (bradikinin-1receptor), ami a gyulladáskeltő kemokinek és citokinek, például a jól ismert IL-6 felszabadulása miatt akut gyulladást vált ki a tüdőben (Colarusso et al., 2020). Ezenkívül a kallikrein/kinin és a renin-angiotenzin rendszer is tromboszabályozó szerepet játszik (Fang és Schmaier, 2020). Adataink a Kininogén-1 kétszeres felfelé történő szabályozódását mutatták ki a COVID-19 betegek exoszómáiban. Maga a Kininogen-1 kapcsolatban áll a véralvadási kaszkáddal, és trombózisellenes célpontként tartják számon. Valóban, génjének delécióját egerekben az indukált trombózis csökkent kockázatával hozták összefüggésbe (Fang és Schmaier, 2020). Hemosztatikus és trombotikus manifesztációk gyakoriak a kritikus állapotú COVID-19 betegeknél, és a vezető halálozási okok között szerepelnek (Al-Samkari és mtsai., 2020 52), míg világszerte nagyszámú vénás tromboembóliás (VTE) eseményt figyeltek meg a COVID-19 tüdőgyulladásban szenvedő súlyos betegek körében (Fontana és mtsai., 2020). A Kininogen-1 szerepére és eredményeinkre támaszkodva feltételezzük, hogy az exoszómák a Kininogen-1 tartalékaként és hordozójaként szolgálhatnak.
A bioinformatikai elemzés rámutatott az IL-6 és a TGFβ1 citokinek részvételére is, mint a modulált fehérje upstream szabályozóira. Az IL-6-ot a SARS-CoV-2 fertőzés által indított gyulladásos és immunválasz fő mediátoraként ismerik el (Grifoni és mtsai., 2020). A COVID-19 betegek exoszomális fehérjéinek upstream szabályozójaként feltételezzük, hogy az IL-6 az EV-ken keresztül a sejtekből történő fehérje-szekréciót is befolyásolhatja. A TGFβ1 egy pleiotróp citokin, amely szabályozó képességekkel rendelkezik, és részt vesz a gyulladásos válasz feloldásában (Sanjabi és mtsai., 2009). A gazdaszervezet fertőzésre adott válaszát a TGFβ1 a citokinvihar és a TNF, IL-1β és IL-6 jelenlétének segítségével szabályozhatja (Chen, 2020). A tüdőfibrózis a COVID-19 fertőzés klinikai jellemzői közé tartozik; valóban a tüdőkárosodás vezető okaként azonosították, amint arról Polak és munkatársai (2020) beszámoltak, akik kimutatták, hogy a betegek 22%-ánál a tüdőkárosodás fibrotikus mintázata intersticiális fibrózissal jellemezhető. Adataink a TGFβ1, a glükóz és az exoszómák közötti összefüggésre is utalnak. Érdekes módon összefüggésről számoltak be a magas glükózkoncentráció és a COVID-19 súlyosbodása között; például a kontrollálatlan glükózszintű cukorbetegek nyilvánvalóan hajlamosabbak a COVID-19 szövődmények manifesztálódására és az ebből következő fokozott halálozásra - bár a molekuláris mechanizmus jelenleg még nem tisztázott (Zhu és mtsi., 2020). A hosszan tartó és nem kontrollált hiperglikémiát szintén prognosztikai tényezőként írták le (Brufsky, 2020). A legfontosabb, hogy az exoszómák kulcsfontosságú szerepéről már beszámoltak a diabéteszes nefropátia patogenezisében: a magas glükózszint a makrofágokból az exoszómák fokozott kiválasztásához vezet a TGF-β1 mRNS-en keresztül, amely hídként működik a makrofágok és a mezangiumsejtek között (Zhu et al., 2019). Hasonló kapcsolat állhat fenn a COVID-19 esetében is, a makrofágok és a tüdősejtek között, még ha további kutatások szükségesek is e hipotézis vizsgálatához.
Vizsgáltuk az exoszomális fehérjék lehetséges szerepét a COVID-19 fertőzés és a betegség súlyosságának diagnosztikai biomarkereiként is. Számos exoszomális fehérje, mint például a CRP, A1AG1, A1AG2, CXCL7, SAMP és ZA2G fehérjék közvetlenül korreláltak a betegség súlyosságával, amint azt a kritikus betegek körében tapasztalt növekedésük mutatta, utalva e fehérjék lehetséges felhasználására a betegség kimenetelének és potenciálisan a terápiákra adott esetleges válasznak a nyomon követésére. Hipotézisünkkel összhangban az exoszomális proteomot már vizsgálták a szepszis progressziójának monitorozására (Xu és mtsai., 2018) és az antiretrovirális terápiának alávetett HIV-betegeknél (Chettimada és mtsai., 2018). Huan és munkatársai azt találták, hogy a COVID-19 betegeknél szignifikánsan megnövekedett a SAA és a CRP szintje, ami arra utal, hogy a SAA biomarkerként szolgálhat a légúti betegségek progressziójának nyomon követésére (Huan és munkatársai, 2020). A CRP-szintek pozitívan korreláltak a tüdőléziók átmérőjével és a súlyos megjelenéssel (Wang, 2020; Matsumoto és mtsi., 2019), de a szervi elégtelenség és a halálozás fokozott kockázatával is (Pierrakos és Vincent, 2010). Egy másik érdekes fehérje, amelyről megállapítottuk, hogy kritikus állapotú betegeknél felszabályozott, a Fetuin-A. Az exoszomális Fetuin-A-t már azonosították, mint az akut vesekárosodás kimutatására szolgáló új vizelet biomarkert. Feltételezzük, hogy a kritikus állapotú COVID-19 betegeknél történő felszabályozása magyarázatot adhat a vesekárosodásra, amelyről gyakran számolnak be súlyos betegeknél (Zhou és mtsai., 2006).
Érdekes módon a validálás során nagyon jó biomarkerjelöltekről számoltunk be - mint például a fibrinogén alfa-lánc, fibrinogén béta-lánc, fibrinogén gamma-lánc, fibronektin, komplement C1r alkomponens és szérum amiloid P-komponens -, amelyek nagyon jó AUC-értékekkel (0,94 és 0,91 között) jeleztek.
Továbbá a SARS-CoV-2 fertőzésben modulált exoszómafehérjék között megtaláltuk a LYVE1-et, a TIMP1-et és a CXCL7-et (5C ábra). Ez az expressziós profil bizonyos mértékig alátámasztja a makrofág-aktivációs szindróma (MAS) szerepét, mint a COVID-19 betegek hiperinflammatorikus válaszának fő hajtóerejét (Schulert és Grom, 2015). Valóban, míg a LYVE-1-et expresszáló makrofágok az artériás merevséget az MMP-9 mátrix metalloproteináz-függő proteolízisének modulációján keresztül szabályozzák (Lim és mtsai., 2018), az MMP-gátló TIMP1 expressziója összefügg a tüdő makrofágok gyakoriságával, és részt vesz az influenza által kiváltott tüdőkárosodásban (Allen és mtsai., 2018), a CXCL7 pedig a makrofágok ismert vonzóereje a tüdőgyulladásban (Unver és mtsai., 2015).
Emellett adataink számos olyan exoszomális fehérje jelenlétét mutatták ki, amelyek ugyanazt az expressziós mintázatot mutatják, mint a COVID-19 betegek szérumában kimutatott fehérjék. A szérum proteomikát általában a keringő szérumfehérjékkel végzik, és nem különböztetik meg a sejtek közötti kommunikációhoz használt exoszóma rakományban található fehérjéket, és ez képet adhat a COVID-19-ben szerepet játszó mechanizmusokról. Az exoszómák szerepe különösen fontos lehet a COVID-19 esetében, mivel a SARS-CoV-2 fertőzés szövetkárosodással és több szerv működési zavarával jár, és a keringő exoszómák potenciálisan több távoli célsejtet és szervet is elérhetnek.
Összességében tanulmányunk eredményei az első bizonyítékot szolgáltatják arra, hogy a keringő exoszómák erősen modulálódnak a COVID-19 fertőzés során, és részt vehetnek a patogenezisben. A vírusanyag jelenléte az exoszómális rakományban azt mutatta, hogy a SARS-CoV-2 a sejtek közötti kommunikációs rendszert használhatja a fertőzés terjedésére a gazdaszervezetben. A plazma exoszómák proteomikai elemzése számos olyan molekulát azonosított, amelyek részt vesznek az immunválaszban, a gyulladásban, valamint a véralvadási és komplement útvonalak aktiválásában, ami az exoszómák jelentős szerepére utal a COVID-19-re jellemző szövetkárosodással és több szervi működési zavarral kapcsolatos mechanizmusokban. Egy másik figyelemre méltó eredmény, amely ezekből az adatokból kiderül, számos olyan potenciális biomarker jelenléte, amelyek jól korrelálnak a betegség súlyosságával. Bár a mai napig a miénk az első olyan tanulmány, amely jellemzi a SARS-CoV-2 fertőzött betegekből származó keringő exoszómális fehérjéket és útvonalakat, a jövőbeni vizsgálatokra van szükség a COVID-19-ben előforduló EV-k számának és méretének meghatározásához. Ezenkívül az exoszóma-tartalom nyomon követése a fertőzés során hozzájárulhat annak jobb megértéséhez, hogy az exoszómák támogatják-e a vírus terjedését, vagy immunológiai védelmet indukálnak.